Hasta el 13 de marzo de 2025, al menos 80 laboratorios farmacéuticos del extranjero no lograron aprobar las inspecciones realizadas por la Dirección General de Medicamentos, Insumos y Drogas (Digemid), encargada de verificar si cumplen con las Buenas Prácticas de Manufactura (BPM). Esta certificación es un requisito esencial para que sus productos puedan ser importados al Perú y comercializados legalmente.
Sin embargo, pese a haber desaprobado estas evaluaciones, 51 de esos laboratorios todavía tienen vigente el registro sanitario de al menos uno de sus medicamentos. Esto ocurre gracias a vacíos en la normativa peruana, que no contemplan una prohibición expresa para retirar del mercado los productos de laboratorios que pierden la certificación. Como resultado, aunque ya no pueden traer nuevos lotes al país, pueden seguir vendiendo el stock que tienen disponible.
Las Buenas Prácticas de Manufactura son un conjunto de estándares internacionales que garantizan que los medicamentos se fabriquen en condiciones controladas, seguras y con calidad comprobada. El certificado que otorga Digemid es el documento que acredita que un laboratorio, sea nacional o extranjero, cumple con estos requisitos. Para emitirlo, inspectores de esta entidad deben viajar a las plantas de producción y realizar una verificación técnica in situ.
En este proceso, la Digemid inspeccionó laboratorios en 19 países —entre ellos Argentina, India, China, Brasil y Bangladesh— y concluyó que 80 no cumplían con los estándares necesarios para obtener la certificación. Así lo detalla un informe oficial enviado por el entonces director de la Digemid, Moisés Mendocilla, al jefe de la Sunat, Víctor Mejía Ninacondor, el 13 de marzo de 2025.
En el documento, Mendocilla incluyó tres listados: el primero, con 385 laboratorios extranjeros que tienen procedimientos pendientes para obtener la certificación de BPM; el segundo, con los 80 laboratorios que ya fueron evaluados y no aprobaron; y el tercero, con 134 laboratorios que fueron excluidos de forma definitiva del proceso, por no haber corregido observaciones técnicas o por haber incumplido con requisitos sanitarios, según lo estipulado en el artículo 4 del Decreto Supremo N.º 012-2023-SA.
Medicamentos sin importación, pero aún a la venta
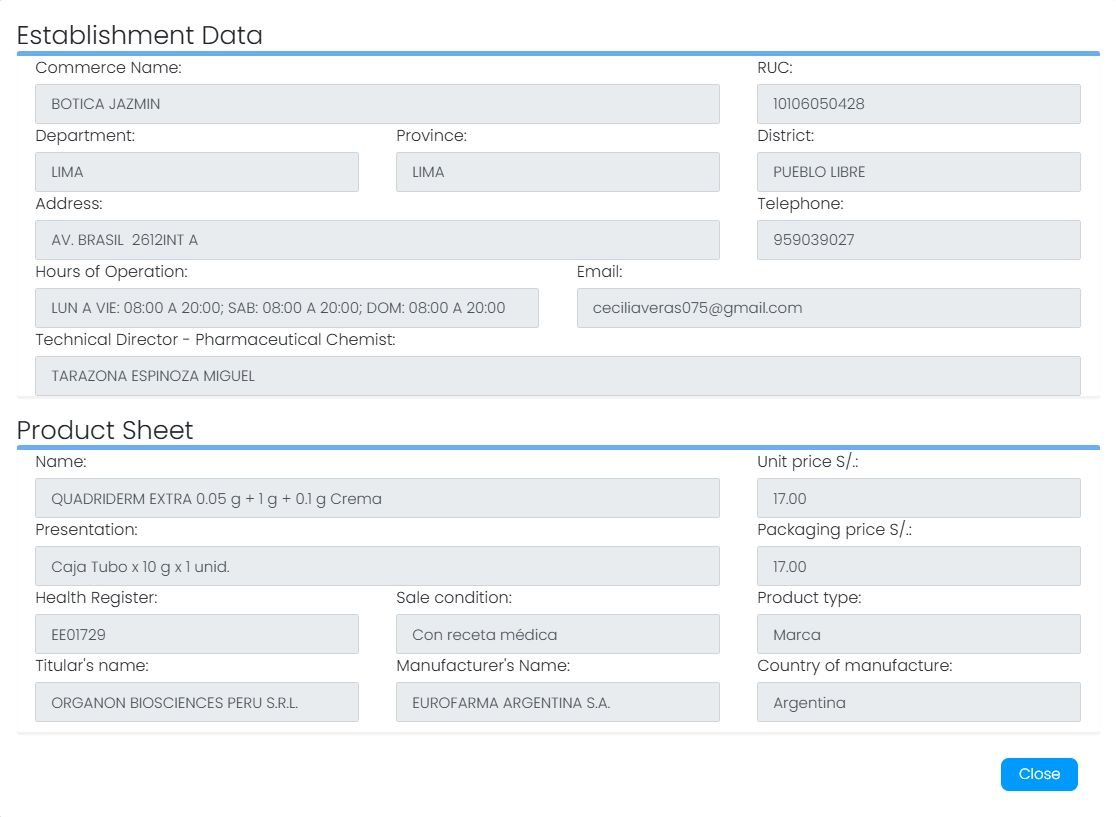
El caso de Eurofarma Argentina S.A. muestra este vacío normativo. Este laboratorio no superó la inspección de BPM realizada por Digemid, lo cual significa que, según la normativa, ya no puede importar nuevos lotes de medicamentos al país de las áreas que no tienen esta aprobación. Sin embargo, mantiene vigente el registro sanitario en al menos dos productos: Suganon 5 mg, un medicamento usado para el tratamiento de la diabetes tipo 2, y Quadrirem Extra, una crema para infecciones cutáneas causadas por hongos o bacterias.
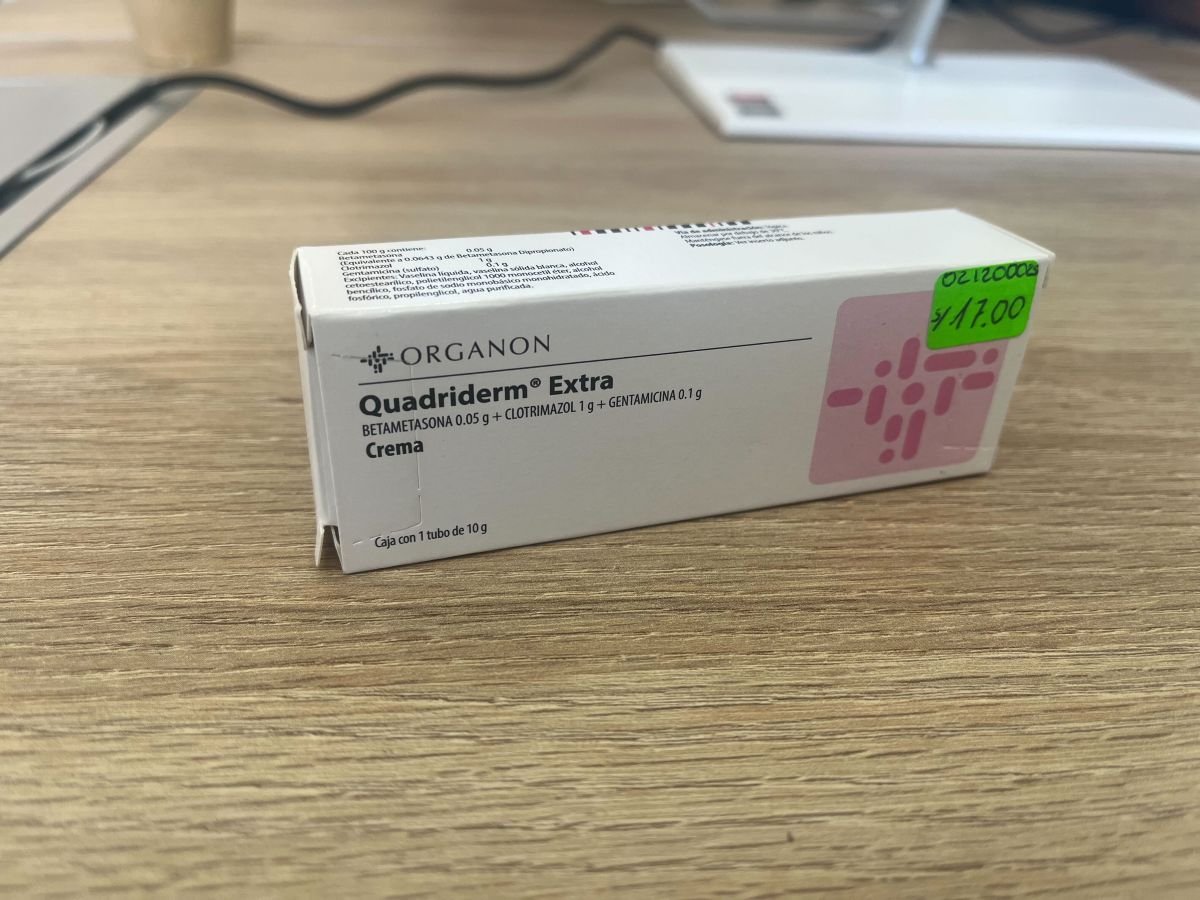

Según el Observatorio Peruano de Productos Farmacéuticos, Suganon se vende en las cadenas Boticas y Salud a S/ 4.41 por tableta, mientras que Quadriderm Extra cuesta S/ 15.90 en Farma Salud, en Lima. En el caso de Quadriderm Extra, este, al ser una crema - ungüento - gel, no contaría con la certificación por BPM correspondiente, ya que, según Digemid, no certificó el área de “Semisólidos: Ungüentos”. La legislación actual no contempla una prohibición explícita para retirar del mercado los medicamentos de laboratorios que perdieron su certificación, lo que permite que sigan siendo vendidos hasta agotar su stock, aunque ya no puedan importar más.
Además, Eurofarma Argentina ha solicitado la cancelación voluntaria del registro de otros cuatro productos. Esta cancelación puede solicitarla el fabricante por diversos motivos, o también puede ser ordenada por la autoridad sanitaria en caso de alertas de seguridad internacional, adulteraciones, falsificaciones u otras razones sanitarias que representen un riesgo para la salud pública.
El caso se amplía si se considera a la empresa matriz: Eurofarma Laboratorios S.A., con sede en Brasil, que también figura en la lista de laboratorios que no obtuvieron la certificación de BPM. Esta filial brasileña tiene una presencia importante en el mercado peruano: 126 productos registrados, entre ellos el antihipertensivo Bart H 150 mg y el antibiótico Aztrocina 500 mg, que pueden encontrarse en Inkafarma a S/ 4.05 y S/ 1.30 respectivamente.
Eurofarma Laboratorios S.A. mantiene 20 productos con registros en proceso de reinscripción, sin embargo, también figura en la lista de Digemid como no aprobado en el área de medicamentos oncológicos para la producción de tabletas y tabletas recubiertas, de acuerdo con el documento enviado el 13 de marzo por esta entidad a Sunat*.
Para el químico farmacéutico y especialista Javier Llamoza, esta situación es preocupante. "Si el laboratorio no cumple con las Buenas Prácticas de Manufactura, sus productos no deberían ingresar al país, y los que ya están en el mercado deberían ser inmovilizados de inmediato hasta que se verifique su calidad", afirma.
En total, Salud con lupa identificó que de los 51 laboratorios extranjeros con inspecciones desaprobadas y que aún tienen productos registrados ante la Digemid, 28 ya cancelaron parte de sus registros, y 26 están en proceso de reinscripción.
Certificación demorada y reglas blandas para nuevos solicitantes
Mientras algunos laboratorios fueron desaprobados, hay otros que aún no han sido inspeccionados por la Digemid. Son 385 laboratorios extranjeros que sí han iniciado el trámite para obtener la certificación de BPM y han pagado el monto correspondiente para que inspectores peruanos viajen a sus sedes.
Sin embargo, la lentitud del procedimiento ha permitido que, mientras esperan la inspección, sigan exportando medicamentos al Perú con solo presentar certificaciones equivalentes emitidas por las autoridades sanitarias de sus países de origen. Esta excepción está permitida por el Decreto Supremo N.º 012-2023-SA y es válida hasta el 23 de mayo de 2028.
Esta medida facilita temporalmente la importación, pero no soluciona el problema de fondo: la certificación nacional sigue pendiente. El proceso es largo y burocrático. Está regulado por la Resolución Ministerial N.º 615-2024-MINSA y exige que cada laboratorio solicite la inspección a través de un trámite formal en la Digemid, que incluye el pago de pasajes y viáticos para dos inspectores, y la aprobación del viaje por parte del Viceministerio de Salud Pública del Ministerio de Salud.
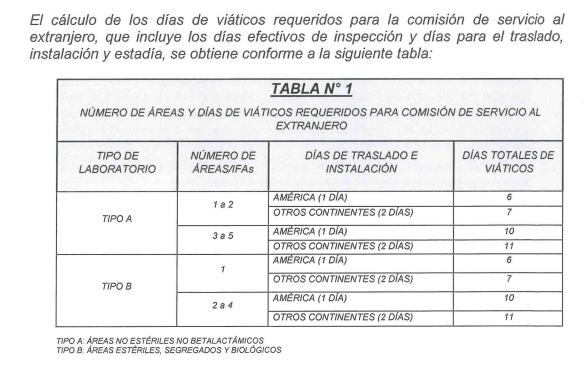
Todo este proceso puede tomar al menos 85 días hábiles. Si no hay observaciones, se programa la inspección, se emite una resolución ministerial que autoriza el viaje, se realiza la diligencia y, finalmente, se emite un informe con el resultado de la evaluación.
Digemid: sin autonomía, con las manos atadas
El documento analizado por Salud con lupa expone los resultados de este sistema lento y poco eficiente. En abril de 2024, había 474 laboratorios extranjeros en espera de su certificación. Un año después, en marzo de 2025, la lista apenas se redujo a 385. Eso implica que Digemid procesó en promedio solo ocho casos al mes. De mantenerse este ritmo, tomaría al menos cuatro años más completar las inspecciones restantes.
En paralelo, el número de laboratorios que no aprobaron la certificación aumentó de 63 a 80 en ese mismo periodo, y los excluidos de forma definitiva crecieron de 45 a 134.
El problema de fondo es estructural. La Digemid no tiene autonomía administrativa ni financiera. Aunque recauda importantes ingresos a través del cobro de tasas por registros y certificaciones, estos fondos no se quedan en la institución, sino que son absorbidos por el Ministerio de Salud, que también tiene la última palabra para autorizar viajes de inspección al extranjero.
“En la Digemid trabajan unas 800 personas. Es una institución técnica que debería tener autonomía, pero no la tiene. Los ingresos que genera se van al Minsa, lo que limita su capacidad operativa”, advierte Llamoza.
La falta de independencia, la maraña burocrática y la escasez de recursos han convertido el control estatal sobre la calidad de los medicamentos en un sistema débil, lento y vulnerable. Hoy, estos problemas se agudizan en un contexto especialmente delicado: la nueva directora de Digemid, Delia Dávila Vigil, asumió el cargo el 8 de abril de 2025, justo cuando estalló la crisis por la tragedia causada por el suero defectuoso de Medifarma. El desafío que enfrenta no es menor: recuperar la credibilidad de una institución clave para la salud pública, en medio de la presión social, las brechas regulatorias y el peso de una industria poderosa.
Actualizado el 12 de abril del 2025.
*En una carta enviada a este medio, Eurofarma adjuntó un certificado de Buenas Prácticas de Manufactura (BPM) vigente desde febrero de 2025, correspondiente a su filial brasileña, Eurofarma Laboratorios S.A. Este certificado contradice la lista publicada por Digemid el 13 de marzo, en la que dicho laboratorio figura como no aprobado en el área de medicamentos oncológicos. Sin embargo, según la empresa, recién fue notificada de la aprobación el 21 de marzo, nueve días después de que Digemid enviara la lista a la Sunat.
En nuestra respuesta a su carta, se precisó que los productos Suganon, Bart H y Aztrocina sí se encuentran conformes con la regulación vigente, de acuerdo con la información proporcionada por el laboratorio. Asimismo, la imagen de Suganon fue reemplazada por la del producto Quadriderm Extra, que sí está disponible en el mercado peruano, pese a que su fabricante, Eurofarma Argentina S.A., no cuenta con el certificado de BPM para este tipo de productos.