El viernes 11 de abril, Salud con lupa recibió una carta de la empresa Eurofarma con cuestionamientos y observaciones a nuestro reportaje titulado “51 laboratorios extranjeros sin certificación de buenas prácticas aún venden medicinas en Perú”. En este artículo, revelamos que un documento oficial de la Dirección General de Medicamentos, Insumos y Drogas (Digemid), enviado el 13 de marzo de 2025 a la Sunat, enumera 80 laboratorios que no obtuvieron la certificación en Buenas Prácticas de Manufactura (BPM). De estos, 51 aún cuentan con registros sanitarios vigentes y sus productos se siguen comercializando en el país, aunque en varios casos ya no pueden importar nuevos lotes. Entre ellos figuran dos plantas de la firma brasileña Eurofarma: Eurofarma Argentina S.A. y Eurofarma Laboratorios S.A.
A continuación, respondemos punto por punto a los argumentos de la empresa:
1.- Sobre el producto Suganon y otros comercializados por Eurofarma Argentina S.A.
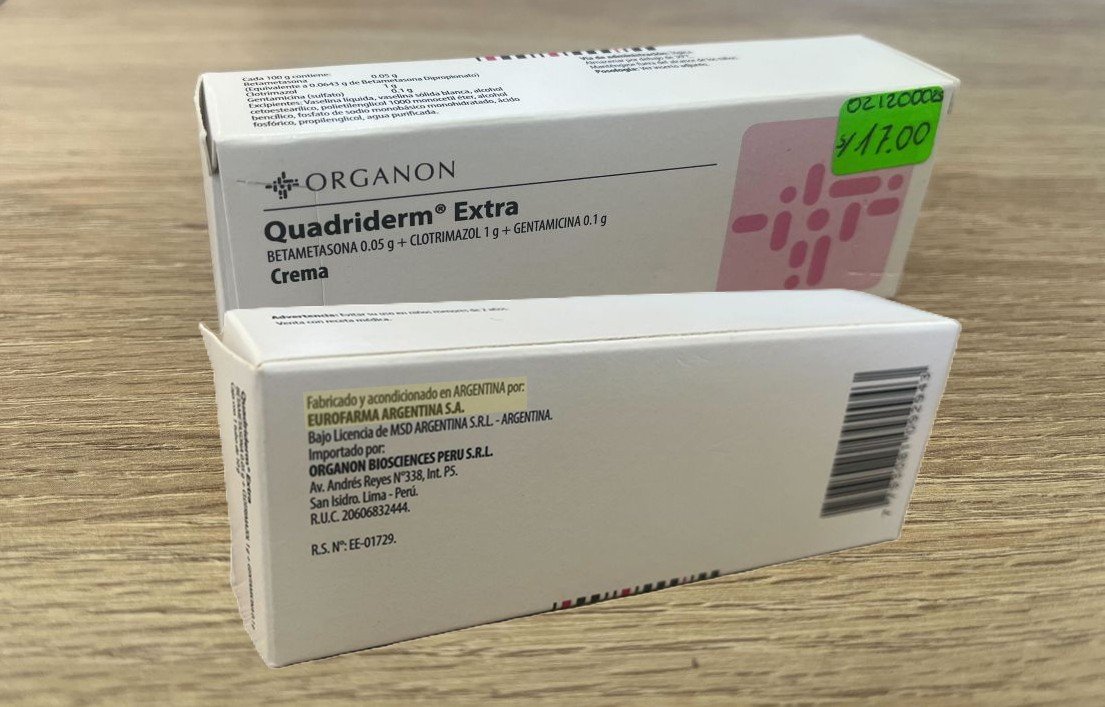
Eurofarma sostiene que Suganon es el único producto importado desde su planta en Argentina. Esta afirmación es incompleta. Nuestro reportaje también menciona Quadrirem Extra 0.05 g + 1 g + 0.1 g, registrado como “Crema - Ungüento - Gel” en el Observatorio Peruano de Productos Farmacéuticos, que cuenta con registro sanitario vigente y está disponible en boticas de Lima.
Aunque Eurofarma no hace referencia a este segundo medicamento en su carta, el documento de Digemid indica que su planta en Argentina no cuenta con BPM vigente para la fabricación de formas semisólidas como ungüentos, categoría a la que pertenece Quadrirem Extra.
La certificación BPM es un requisito indispensable para importar medicamentos al Perú. No contar con ella impide la autorización de nuevos ingresos al país, aunque la normativa permite la comercialización de productos ya presentes en el mercado hasta agotar stock.
Eurofarma también afirma que el documento oficial de Digemid se refiere a formas farmacéuticas que no se comercializan en Perú. No obstante, esta aseveración se contradice con la realidad: Quadrirem Extra sí está a la venta actualmente en el país.
Sin embargo, cabe mencionar que Eurofarma precisa para el caso de su laboratorio en Argentina, que este cuenta con un certificado de BPM para tabletas recubiertas y cápsulas. Este documento, remitido también por la compañía, permite la comercialización e importación de Suganon, por lo cual se realizó la aclaración correspondiente en el artículo original.
2.- Sobre la certificación reciente de BPM en Brasil
Eurofarma informa que su planta en Brasil obtuvo una recertificación de BPM para productos oncológicos el 21 de febrero de 2025. Adjunta además una copia del certificado con vigencia hasta 2030.
No obstante, es importante subrayar que el informe oficial de Digemid que citamos fue emitido el 13 de marzo de 2025, y la notificación de esta nueva certificación fue enviada a la empresa recién el 21 de marzo, según consta en la documentación. Es decir, al momento de elaborarse la lista oficial, Eurofarma Brasil seguía figurando entre los laboratorios sin certificación vigente en el área específica evaluada.
La actualización de estos listados es competencia exclusiva de Digemid. Por lo tanto, la información publicada en nuestro reportaje corresponde al estado oficial vigente en la fecha señalada.
3.- Sobre los medicamentos Barth y Astrocina
En su carta, Eurofarma se refiere a Barth y Astrocina, fabricados en su planta de Brasil, los cuales también figuran en nuestra investigación por tener registros sanitarios vigentes. Aclaramos que el reportaje no afirmó que estos productos estuvieran impedidos de venderse por falta de BPM, sino que los mencionó en el contexto de 20 medicamentos en proceso de reinscripción, con la observación de que sin una certificación vigente, no podrían importarse nuevos lotes.
No obstante, sí nos corresponde hacer una aclaración importante: ambos productos están respaldados por un certificado de BPM otorgado por Digemid el 23 de octubre de 2024, válido hasta 2029. Esta certificación cubre una amplia gama de formas farmacéuticas, entre ellas cremas, soluciones inyectables y tabletas. Es distinta de la certificación obtenida en febrero de 2025, referida exclusivamente a productos oncológicos en tabletas, cápsulas y tabletas recubiertas.
El reportaje de Salud con lupa se elaboró con base en documentos oficiales y fuentes públicas confiables, como el Observatorio Peruano de Productos Farmacéuticos. Gracias a ello, se pudo identificar un vacío preocupante: la presencia de laboratorios que, pese a no contar con BPM vigentes o en espera de obtenerlas, siguen comercializando productos en el país, mientras Digemid —limitada en recursos y autonomía— no logra ejercer un control integral sobre la calidad de los medicamentos que circulan en el mercado.