La serie Las pastillas y yo tiene el apoyo del

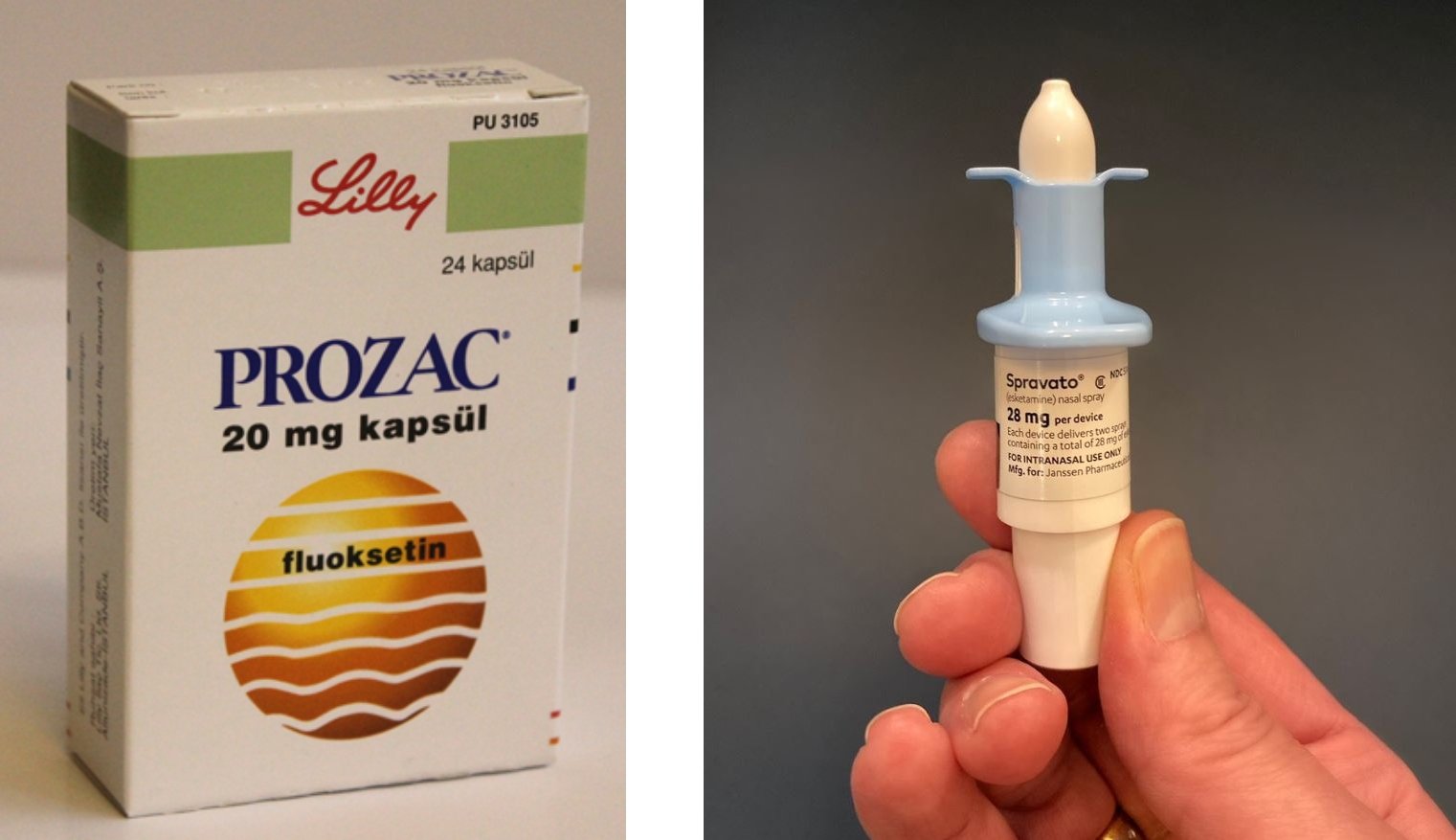
D esde la revolución de las pastillas de Prozac hasta el spray nasal Spravato como el último tratamiento de la depresión, las farmacéuticas han desarrollado un lucrativo mercado de medicinas psiquiátricas que funciona bajo el paradigma de que los trastornos mentales se deben, principalmente, a un desequilibrio químico del cerebro, un desarreglo físico que se puede reparar con medicamentos. Aunque en los últimos años se han producido estudios científicos que ponen esa premisa en tela de juicio, los laboratorios compiten por el descubrimiento y desarrollo de nuevas moléculas que reemplacen a sus fármacos que han ido perdiendo patentes y tienen ahora versiones genéricas más baratas.
Ocho gigantes farmacéuticos lideran este negocio a través de asociaciones, fusiones, adquisiciones y colaboraciones con otras empresas para ampliar su línea de medicinas que actúan sobre el sistema nervioso central: los laboratorios estadounidenses Pfizer, Eli Lilly & Company, AbbVie y Johnson & Johnson; las japonesas Takeda y Otsuka, la multinacional suiza Novartis y la danesa Lundbeck. Estas corporaciones participan en un mercado que se valoró en US $36 mil millones en 2020 y se prevé que alcance los US $58 mil millones para 2031, según la consultora británica Visiongain.
Con una oferta de medicamentos basados en fórmulas químicas sobre las que ya han perdido los derechos de exclusividad de uso, las grandes empresas se apoyan en distintas tácticas de márketing que inclinen a los psiquiatras a recetar sus marcas en lugar de los genéricos que producen otros laboratorios. Por ejemplo, los antidepresivos Prozac (fluoxetina), Zoloft (sertralina), Lexapro (escitolapram) y el ansiolítico Xanac (alprazolam) tienen más de una docena de versiones genéricas que cuestan la mitad de su precio, pero muchos doctores los ponen como primeras alternativas terapéuticas porque son promovidos “como mejor tolerados por los pacientes”.
En casi cuatro décadas, el desafío de encontrar la próxima generación de medicamentos innovadores para trastornos mentales como la depresión, que afecta a más de 350 millones de personas en el mundo, ha sido una apuesta de varios tropiezos y de inversiones que se han quedado en el camino. La investigación clínica sólo había girado en torno a fármacos con el mismo mecanismo de acción que los productos desarrollados a fines de la década de 1980 y 1990, conocidos como los Inhibidores Selectivos de la Recaptación de Serotonina (ISRS), pero en los últimos años la industria farmacéutica cree haber identificado un nuevo horizonte terapéutico por una droga anestésica muy antigua, la ketamina.
En 2019, Janssen Pharmaceutical, la subsidiaria de Johnson & Johnson, consiguió la aprobación de Spravato, un spray nasal producido de ketamina, como tratamiento contra la depresión severa por parte de las agencias reguladoras de medicamentos de Estados Unidos y la Unión Europea. Desde entonces, leemos cada vez con más frecuencia noticias sobre la revolución que puede causar esta molécula con un mecanismo de acción distinto al de los antidepresivos tradicionales. La ketamina es un anestésico disociativo utilizado desde los años setenta, con propiedades sedantes y analgésicas, que actúa como inhibidor de los receptores NMDA (N-metil-D-aspartato) del cerebro, asociados con los estados de dolor agudo, particularmente, el dolor neuropático. Se ha estudiado que puede aliviar los síntomas antidepresivos a dosis bajas, mucho menores a las utilizadas como anestésico.
Sin embargo, las primeras revisiones independientes de los ensayos clínicos del fármaco han dejado aún varias dudas sobre su eficacia y seguridad a la comunidad científica, sin contar con el elevado precio de la terapia (cerca de 50.000 dólares anuales en Estados Unidos) que obliga a los sistemas de aseguramiento de salud a evaluar si este medicamento, en términos de costo y beneficio, representa ahora una alternativa mejor a las disponibles para los pacientes. Además, el spray de ketamina sólo puede administrarse en hospitales al estar producido con una sustancia considerada de riesgo de adicción. Las personas que lo usen deben ser monitoreadas por un profesional de salud en cada sesión en un ambiente con las condiciones clínicas necesarias, lo que aumenta los costos de esta terapia.
El laboratorio Allergan, que fue adquirido por AbbVie, ha probado también un fármaco derivado de la ketamina como tratamiento de la depresión severa, pero la compañía abandonó la investigación después de que tres de sus ensayos clínicos no ofrecieron los resultados esperados de eficacia y seguridad. Desde entonces, AbbVie, en asociación con Gedeon Richter Pharmaceutical, se concentró en desarrollar el antipsicótico Vraylar (cariprazina) como alternativa para controlar los síntomas de episodios depresivos asociados con el trastorno bipolar y como terapia contra la esquizofrenia en adultos. En mayo de 2019, el medicamento fue aprobado en Estados Unidos e incluye en su prospecto una información de seguridad importante sobre el aumento del riesgo de muerte en adultos mayores con psicosis relacionada con demencia; pensamientos y comportamientos suicidas.
Actualmente, hay al menos 160 medicamentos para trastornos mentales que se están probando y que están en distintas fases de ensayos clínicos en Estados Unidos. Este es un número mayor al del 2019, cuando se registraron 138 terapias en desarrollo, según datos que revisamos en la plataforma Pharmaceutical Research and Manufacturers of America (PhRMA), asociación que representa a las compañías de investigación y fabricación farmacéutica y biotecnológica. Los tratamientos potenciales para la depresión, incluida la depresión posparto y el trastorno depresivo mayor, suman 54 ensayos clínicos y están patrocinados por Takeda, Otsuka, Janssen, Lundbeck y Boehringer Ingelheim, además de una veintena de laboratorios de biotecnología que participan en asociaciones con farmacéuticas más grandes.
¿Para qué problemas de salud mental se están probando nuevos medicamentos?
- Solicitud presentada
- Fase I
- Fase II
- Fase III
El futuro de los antipsicóticos
Las investigaciones clínicas de antipsicóticos para la esquizofrenia, una enfermedad que afecta a 24 millones de personas en el mundo, concentran el interés de las farmacéuticas debido a que, como ocurre con los antidepresivos, desde finales de los años ochenta no se han producido medicamentos mejores en eficacia y seguridad que los disponibles. La piedra angular de los llamados antipsicóticos es la regulación de la psicosis a través del control de los niveles de dopamina, pero sólo consiguen aliviar en cierta medida a los pacientes y sus componentes suelen desencadenar efectos secundarios no deseados, a veces abrumadores. Por eso, muchos simplemente dejan de tomar su medicación.
Sin embargo, la xanomelina-trospio ha sido considerada una sustancia novedosa para disminuir la transmisión de la dopamina en pacientes con esquizofrenia y lograr reducir los síntomas (alucinaciones, retraimiento social, alteraciones de la memoria de trabajo y del funcionamiento ejecutivo) sin demasiadas reacciones adversas. Aunque la dopamina parece ser un factor clave, no está claro qué es lo que desencadena exactamente la esquizofrenia. Pero la necesidad de mejores tratamientos es evidente. Esta enfermedad es una de las principales causas de discapacidad en todo el mundo, cerca del 80% deja de trabajar y se acorta la esperanza de vida de los afectados entre una y dos décadas.
Durante los últimos 30 años, la industria farmacéutica invirtió en al menos 250 estudios clínicos en decenas de medicamentos dirigidos a neurotransmisores distintos a la dopamina para ver si funcionaban mejor, pero todos fracasaron. El antipsicótico KarXT (xanomelina-trospio), de Karuna Therapeutics, se centra también en las neuronas dopaminérgicas (las células nerviosas del cerebro que producen dopamina), pero vinculadas a receptores específicos: M1 y M4. La xanomelina era conocida desde hacía tiempo por su eficacia para aliviar los síntomas psicóticos, pero también conllevaba algunos efectos secundarios no deseados, como náuseas y vómitos. Karuna Therapeutics dice haber resuelto este problema añadiendo cloruro de trospio, que ayuda a controlar los efectos secundarios comunes que produce la xanomelina cuando esta se administra sola.
En agosto de 2022, los resultados iniciales de un ensayo de fase III con unas 250 personas mostraron que el fármaco reducía significativamente la gravedad de los síntomas de la esquizofrenia. Karuna Therapeutics tiene previsto presentar el fármaco a la FDA a mediados de este año, según su presidente y director ejecutivo, Bill Meury.
La seguridad de las medicinas
Los llamados psicofármacos están entre los tres tipos de medicamentos que presentan más problemas de seguridad no contemplados en su prospecto tras su aprobación por las agencias reguladoras. “Gran parte de los nuevos riesgos identificados en las medicinas en general no son graves, pero ponen de manifiesto la importancia de vigilar el efecto de los medicamentos a lo largo de los años”, señala Joseph Ross, doctor de la Universidad de Yale en Estados Unidos, quien hizo un análisis de 222 fármacos aprobados por la FDA entre 2001 y 2010. Según su estudio, la mayoría de veces el Comité de Seguridad de la agencia reguladora optó por ordenar a los fabricantes que añadan un rectángulo negro de precaución a la información del producto.

Está claro que todo medicamento tiene beneficios y riesgos. Los potenciales riesgos de causar efectos secundarios o adversos al ser sustancias ajenas al organismo y que como personas únicas que somos, cada paciente puede responder de manera diferente al mismo fármaco. Pero si varios de esos efectos adversos eran conocidos por el laboratorio y no fueron informados a las agencias sanitarias reguladoras para su aprobación, se convierte en un problema de ocultamiento o minimización de daños en perjuicio de la salud y la vida de las personas. Por esa razón, algunos casos de comunicados de seguridad en los prospectos de medicinas psiquiátricas han generado demandas colectivas de pacientes y multas millonarias contra los fabricantes.
Esto ocurrió con el antipsicótico Risperdal (risperidona), fabricado por Johnson & Johnson, y sus efectos de aumento de peso, cambios metabólicos y hormonales dañinos en las personas que los tomaron en terapias para la esquizofrenia y trastorno bipolar. Pasó también con el antidepresivo Cymbalta (duloxetina), producido por Eli Lilly & Company, debido a las reacciones adversas que aparecían cuando se dejaba de tomar de manera regular, desde náuseas, vómitos, irritabilidad, hormigueo hasta zaps cerebrales, un síntoma descrito por los afectados como una sensación de electrocución en la cabeza. Y sucedió con el antipsicótico de Pfizer comercializado bajo el nombre de Geodon (ziprasidona), cuya ficha se actualizó con una alerta sobre el aumento de riesgo de muerte en pacientes mayores con demencia.
Tácticas de ventas y corrupción
Con pocos hallazgos de nuevas moléculas para medicinas de salud mental, la industria farmacéutica ha aplicado diversas tácticas para mantener la rentabilidad de sus productos, aunque no siempre dentro de los márgenes de la ley. Estas estrategias incluyen la prolongación de sus patentes al conseguir nuevas aprobaciones de uso para antiguos medicamentos. Eli Lilly lo hizo con su antidepresivo Cymbalta (duloxetina), autorizado originalmente para la depresión severa en adultos en 2004. En el 2006, se aprobó para la neuropatía diabética o daños en los nervios que sufren las personas con diabetes; en el 2007 para el trastorno de ansiedad generalizado y en el 2008 para tratamiento de la fibromialgia.
Otra de las tácticas usadas es la difusión de evidencia sesgada para promover que los doctores receten ciertos fármacos fuera de las indicaciones para las que fueron aprobados (el llamado uso off label de medicamentos) y sobornos para direccionar las prescripciones. Por ejemplo, Pfizer ha llegado a varios acuerdos extrajudicialescon la justicia estadounidense, que incluyen el pago de grandes multas, por la promoción de usos no aprobados de sus medicamentos. Solo en el caso de Neurontin pagó 430 millones de dólares por haber promovido su prescripción en pacientes con trastorno bipolar cuando solo estaba aprobado para la esquizofrenia. Su competidor británico, el laboratorio GSK, fue multado con 3.000 millones de dólares por haber promovido durante años la prescripción en niños de su antidepresivo Paxil, autorizado únicamente para adultos.
En otro caso, Eli Lilly promovió y vendió su antipsicótico Zyprexa (olanzapine) como terapia para el Alzheimer, cuando este medicamento sólo estaba aprobado para controlar los síntomas del trastorno bipolar y la esquizofrenia. En el 2009, después de años en los tribunales, la compañía aceptó pagar 1420 millones de dólares como parte de un acuerdo extrajudicial con las autoridades federales en Estados Unidos por los problemas relacionados con este producto.

La empresa ha enfrentado también demandas de usuarios que la acusaron de haber ocultado los efectos adversos de Zyprexa. Los ensayos clínicos habían revelado que el 16% de las personas que lo tomaban engordaban más de 18 kilos al año, lo que podría resultar riesgoso en personas con diabetes y problemas cardiacos. Sin embargo, la compañía no había comunicado esa reacción adversa del medicamento. Por este caso, Eli Lilly llegó a un acuerdo legal con 14 grupos de afectados en Estados Unidos para detener las demandas colectivas a cambio del pago de unos 500 millones de dólares. Aún así, la empresa dijo que continuaría defendiendo su fármaco Zyprexa que se prescribe y comercializa en distintas partes del mundo.
Johnson & Johnson y sus subsidiarias también han sido multadas con más de 2.200 millones de dólares por haber promocionado Risperdal y otros dos medicamentos para usos distintos para los que fueron autorizados. Según la resolución en la que acepta los cargos de conducta criminal y violación del código civil, la multinacional había pagado también sobornos a médicos para que recetaran este antipsicótico como terapia para personas adultas mayores con demencia, un uso no aprobado, y para los niños antes de que la FDA aprobara por primera vez su empleo en población infantil. La multinacional ha recibido otra multa de 124 millones de dólares por haber ocultado los efectos adversos de Risperdal, como alteraciones del metabolismo y hormonales. Johnson & Johnson ya no tiene la patente de este medicamento y ahora existen varias versiones genéricas en el mercado, ya que sigue siendo recetado en pacientes con trastorno bipolar y esquizofrenia.
El problema con el sistema de multas está en que cuando son muy inferiores a los beneficios económicos ya obtenidos con el fármaco, dentro de la lógica de una economía de mercado como la que tenemos, dichas conductas no han cesado. Desde 1991 hasta 2018, las compañías farmacéuticas pagaron US$35.700 millones en sanciones civiles y penales en Estados Unidos, más que cualquier otra industria. Solo GlaxoSmithKline pagó US$7.900 millones en multas, de los cuales US$127 millones fueron por actos criminales al negarse a entregar datos a la FDA. Casi ningún ejecutivo de una compañía farmacéutica ha ido a la cárcel por delitos que afectaron la salud y la vida de las personas. Una realidad que eclipsa la medicina psiquiátrica y que ha generado que movimientos de usuarios de salud mental exijan con más fuerza su derecho a una elección terapéutica informada en los consultorios de sus médicos como lo hemos expuesto en nuestra serie investigativa.










