—Me dieron dos opciones: buscar el medicamento por mi cuenta o cambiar de terapia. Ninguna se pudo hacer.
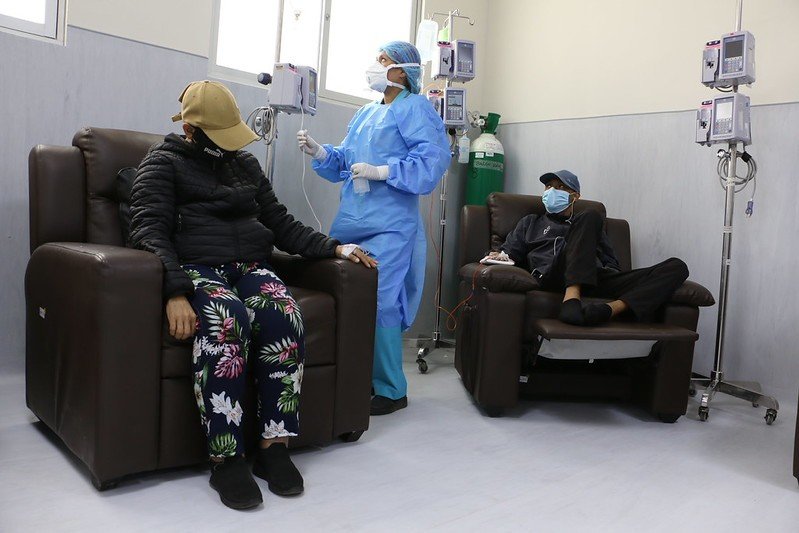
Hugo* tiene 19 años y estudia electrónica industrial. Desde marzo de 2025 recibe quimioterapia en el Instituto Nacional de Enfermedades Neoplásicas (INEN), donde cada año se atienden unos 12.500 pacientes. Le diagnosticaron un tumor mixto de células germinales que ya había hecho metástasis y se encontraba en la parte posterior del abdomen.
En octubre debía recibir su tercera sesión. Pero el hospital no contaba con ifosfamida, uno de los tres fármacos esenciales de su tratamiento.
—Fue muy angustiante. Uno ya está enfermo y encima tiene que pensar si habrá o no medicamento.
Pasó casi un mes antes de que lo llamaran para retomar su quimioterapia. En total, transcurrieron 50 días entre una dosis y la siguiente, cuando debía recibirlas cada tres semanas.

No fue un problema de presupuesto ni de falta de compra. El Centro Nacional de Abastecimiento de Recursos Estratégicos en Salud (Cenares), encargado de proveer a los hospitales del Ministerio de Salud, había adquirido miles de frascos de ifosfamida para cubrir la demanda nacional. Pero esos productos terminaron en la basura.
La Dirección General de Medicamentos, Insumos y Drogas (Digemid) determinó que un lote de 10.000 unidades de ifosfamida, fabricado por la empresa india United Biotech, no era estéril y contenía partículas extrañas. Por ello, el contrato con la importadora World Drug Pharmaceutical fue resuelto y el lote destruido. No era la primera alerta sobre ese fabricante: dos años antes, otros productos de United Biotech ya habían sido observados por la presencia de vidrio y pelusas.
La falta de ifosfamida se extendió a otros 17 hospitales del país en octubre de 2025. Tres —Sergio Bernales, Cayetano Heredia y María Auxiliadora— no tenían ninguna unidad disponible. Los otros 14 trabajaban con menos frascos de los necesarios para atender a todos sus pacientes. Eso obligó a retrasar las quimioterapias y dejó a personas esperando un tratamiento que no puede interrumpirse sin aumentar el riesgo de que la enfermedad avance.
Lo ocurrido con la ifosfamida fue parte de un problema más amplio. Una investigación de Salud con lupa y The Bureau of Investigative Journalism muestra que la escasez de fármacos esenciales para quimioterapia en hospitales públicos del país está vinculada a un sistema que no garantiza controles efectivos y permite la compra de productos con graves fallas de calidad. Estos ingresan al Perú, se distribuyen y, finalmente, deben ser destruidos.
Entre 2019 y 2025, el Ministerio de Salud adquirió 19 lotes defectuosos de cuatro oncológicos esenciales —cisplatino, ifosfamida, ciclofosfamida y doxorrubicina— usados en quimioterapia para tratar distintos tipos de cáncer. Algunos llegaron con contaminación bacteriana. Otros contenían partículas visibles, como pelusas o fragmentos de vidrio. En un caso, la concentración era menor a la declarada; es decir, la dosis no alcanzaba para producir el efecto terapéutico esperado.
Como resultado, más de 140.000 frascos fueron descartados, equivalentes a S/ 3,4 millones. Esa inversión no se tradujo en quimioterapias que pudieran aplicarse. Cada frasco destruido fue una sesión que no llegó a tiempo a un paciente.
Retirar medicamentos defectuosos es indispensable. Pero cuando no hay reemplazo inmediato, el hospital se queda sin alternativa. En un país donde uno de cada cuatro pacientes con cáncer ya enfrenta retrasos en su tratamiento por falta de medicinas, la llegada de productos inseguros profundiza una escasez que el sistema no logra resolver.
Los lotes comprometidos pertenecían a cinco laboratorios de la India: Beta Drugs, United Biotech, Kwality Pharmaceuticals, Vee Excel Drugs & Pharmaceuticals y Naprod Life Sciences. Empresas que continúan vendiendo medicamentos oncológicos al Estado peruano, la mayoría sin certificaciones vigentes de sus plantas de fabricación.
Las farmacéuticas extranjeras que abastecen al país deberían contar con un certificado de Buenas Prácticas de Manufactura (BPM), que acredita que producen bajo estándares internacionales de calidad y seguridad. Sin embargo, desde 2013, la Digemid no ha logrado realizar las inspecciones necesarias para emitir esos certificados a tiempo.
Para evitar que el mercado se paralice, el Ministerio de Salud decidió exonerar temporalmente este requisito a los laboratorios que estén en lista de espera para ser inspeccionados. Esa excepción seguirá vigente, al menos, hasta 2028. La medida ha permitido que los productos sigan ingresando, pero también ha ampliado el margen de riesgo.
Al menos tres de los laboratorios con plantas en India que identificamos ya tenían antecedentes de haber vendido al Perú otros fármacos con fallas de calidad. El historial de Naprod Life Sciences incluye la fabricación de un lote de metotrexato contaminado con bacterias que causó la muerte de cuatro niños en Colombia en 2020. Pese a este grave episodio, el Estado peruano continuó comprándole, incluso el mismo fármaco vinculado a esas muertes.
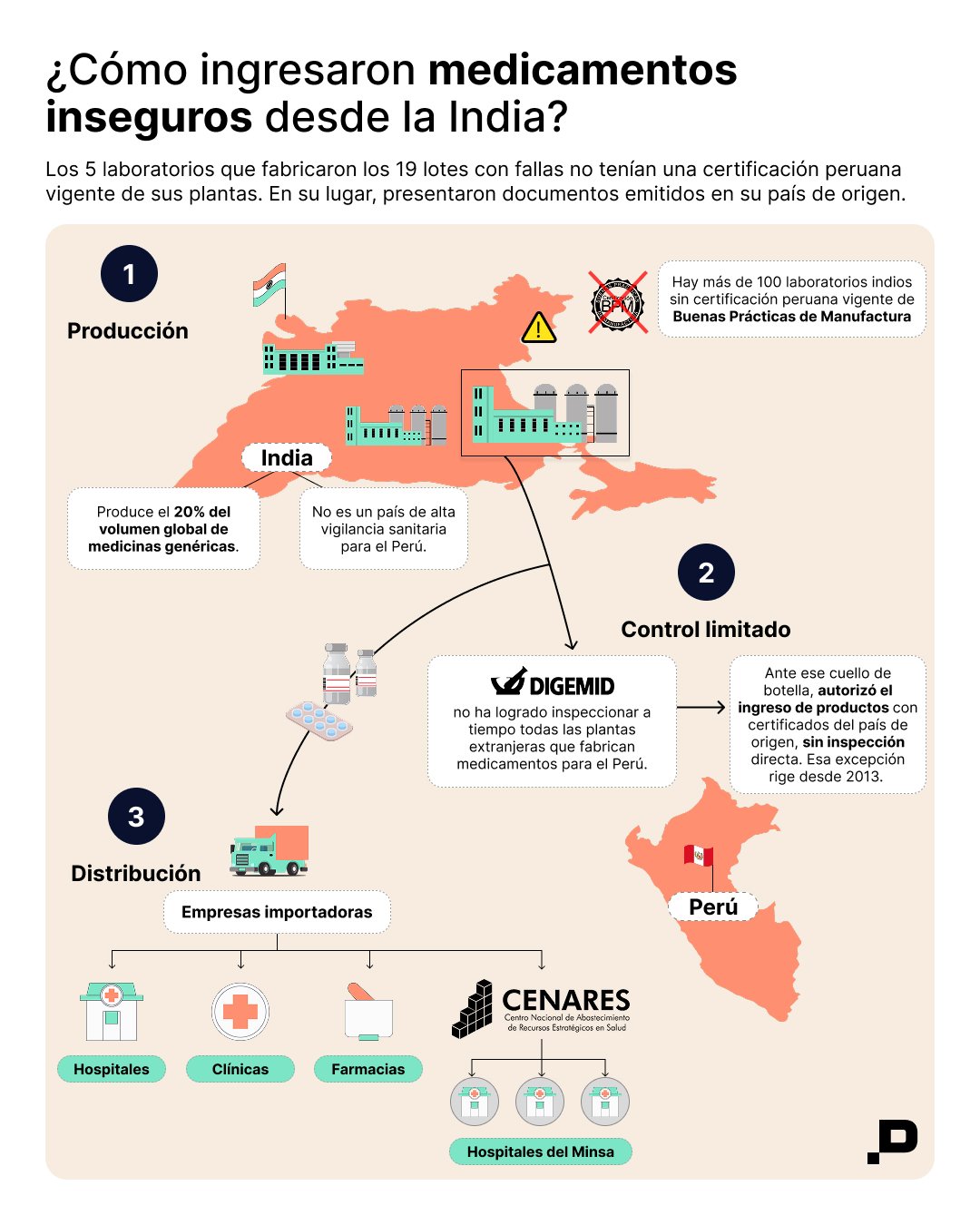
La serie que presentamos hoy nació a partir de un estudio internacional publicado en The Lancet Global Health, que documentó fallas graves en siete medicamentos genéricos esenciales contra el cáncer: cisplatino, ciclofosfamida, doxorrubicina, ifosfamida, leucovorina, metotrexato y oxaliplatino. Estos fármacos eran fabricados por 17 laboratorios, la mayoría con plantas en India.
Muchos de los productos analizados contenían una cantidad insuficiente de ingrediente activo —en varios casos, menos del 88 % de lo indicado en la etiqueta—, lo que puede hacer que el tratamiento no funcione como debería o permita que la enfermedad avance. Otros superaban el 112 %, una concentración que aumenta el riesgo de efectos tóxicos graves.
Estos medicamentos se comercializan en más de 100 países. Entre 2019 y 2025, Perú fue el segundo con mayor volumen de importación de estos genéricos para quimioterapia, después de Estados Unidos, según datos de ImportGenius. Ante ese hallazgo y en alianza con The Bureau of Investigative Journalism, rastreamos contratos públicos, revisamos alertas sanitarias y analizamos qué había ocurrido con esos productos en los hospitales del país.
El cisplatino contaminado que llegó a 16 hospitales
En agosto de 2024, cajas de cisplatino salieron del almacén central del Cenares rumbo a hospitales públicos del país. Eran parte de una compra de 25.000 frascos realizada en abril a la importadora Pharmaris Perú. El medicamento, fabricado por el laboratorio indio Beta Drugs, es un componente central de quimioterapias contra el cáncer de cuello uterino, pulmón, vejiga y ovario.
A inicios de ese mismo mes habían ingresado al país 15.000 unidades correspondientes a tres lotes que fueron aceptados sin observaciones. Entre el 19 de agosto y el 4 de septiembre, más de 7.000 frascos fueron distribuidos a 16 hospitales de Lima, Piura, La Libertad, Lambayeque, Arequipa, Callao y San Martín.

El procedimiento del Cenares establece que el medicamento solo puede distribuirse después de que la empresa titular del registro sanitario envíe muestras a un laboratorio autorizado por el Instituto Nacional de Salud y se obtengan los resultados. El Cenares sostiene que nunca despacha fármacos sin cumplir ese control. En este caso, la distribución comenzó antes de que los análisis estuvieran listos. La urgencia por abastecer servicios oncológicos que estaban por quedarse sin stock aceleró la decisión.
El 30 de agosto, mientras los envíos aún estaban en curso, Pharmaris Perú advirtió por escrito que un lote presentaba partículas extrañas y que el medicamento no debía utilizarse. La empresa solicitó el retiro de ese envío y, por precaución, de los otros dos lotes.
Durante dos semanas el producto permaneció en las farmacias de los hospitales. Recién el 9 de setiembre, el Cenares pidió por correo electrónico que se devolvieran con urgencia todos los viales.
En al menos un hospital, cuando llegó el aviso, era demasiado tarde.
No fue un proceso administrativo ni penal el que permitió reconstruir lo ocurrido. Lo supimos al solicitar información, bajo la Ley de Transparencia y Acceso a la Información Pública, a los 16 hospitales que recibieron el cisplatino defectuoso. Solo ocho respondieron.
En conjunto, esos ocho establecimientos —los institutos especializados en cáncer de La Libertad y Arequipa; el Instituto Nacional de Salud del Niño de San Borja; y los hospitales Hipólito Unanue, María Auxiliadora, Sergio Bernales, Cayetano Heredia y el de Emergencias de Villa El Salvador— recibieron 1.410 viales. Todos informaron que los devolvieron tras la advertencia.
Solo el hospital Sergio Bernales reportó que antes de recibir la comunicación se habían utilizado siete frascos de cisplatino. No existe información pública sobre el seguimiento a esos pacientes ni sobre posibles efectos adversos. Tampoco se abrió una investigación que esclareciera el caso.

La falta de información no es un detalle menor. Javier Llamoza, químico farmacéutico y vocero de Acción Internacional para la Salud, es enfático:
—No son riesgos hipotéticos. Ya lo vimos en 2025 con el suero fisiológico que tenía demasiado sodio y terminó causando siete muertes. Y también con un sedante contaminado que se administró a 28 pacientes en UCI, incluidos bebés.
La compra de cisplatino defectuoso dejó a varios hospitales sin el medicamento y obligó a interrumpir terapias. El intento de reposición tampoco funcionó: el nuevo lote fue declarado no conforme por la presencia de partículas visibles.
Con dos entregas fallidas y sin reemplazo inmediato, el Cenares impuso una penalidad de S/ 316.000 y resolvió el contrato. El caso está en arbitraje. Todos los lotes observados fueron destruidos.
El fabricante, Beta Drugs, discrepó de los análisis realizados en el Perú. Desde la India aseguró que el producto era seguro, que había superado los controles en su país y que no había recibido reclamos desde 2008. También anunció que enviaría muestras a laboratorios acreditados en India y en Estados Unidos.
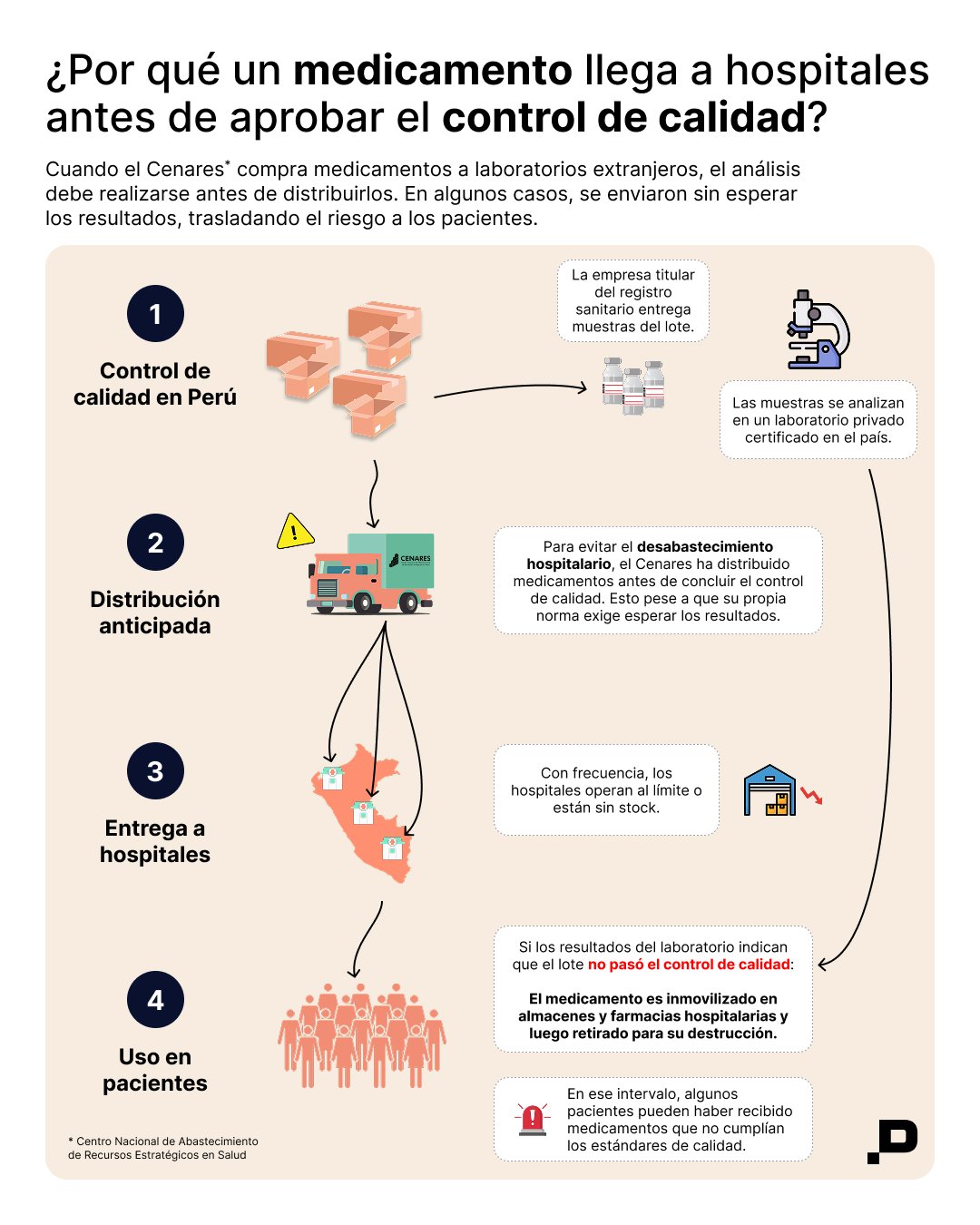
Tras el episodio, el Cenares modificó su Directiva de Control de Calidad y dispuso que el primer lote de cada compra pase por un análisis adicional antes de distribuirse. Sin embargo, el problema no se resolvió de inmediato. En abril de 2025, la Contraloría advirtió que el almacén del Cenares no tenía stock de cisplatino. La distribución prevista para el primer trimestre no se cumplió y, al cierre del reporte correspondiente al segundo, solo se había distribuido el 10%.
Entre la escasez y la dependencia
Hace pocos días, el Instituto Peruano de Economía presentó un reporte que pone cifras a una experiencia cotidiana en los hospitales públicos: en 2025, al menos uno de cada cinco medicamentos oncológicos estaba desabastecido o en substock en el Instituto Nacional de Enfermedades Neoplásicas de Lima y en los institutos regionales de La Libertad, Arequipa y Junín.
Ese desabastecimiento tiene consecuencias clínicas inmediatas. Las quimioterapias se aplican en ciclos estrictos y responden a esquemas definidos. Si el medicamento no está disponible, el tratamiento se modifica. A veces no hay otra opción.
El doctor Víctor Palacios, quien dirigió la Dirección de Prevención y Control del Cáncer del Ministerio de Salud entre 2018 y 2024, ha visto este escenario repetirse durante años.
—Eso aumentaba el riesgo de que la enfermedad regresara, avanzara más rápido o incluso de que la persona muriera. Era muy duro. Con el director del Cenares en esos años nos mirábamos y decíamos: ¿qué más podemos hacer? —recuerda.
Cada año se detectan más de 81.000 nuevos casos de cáncer en el país y la enfermedad es la tercera causa de muerte, según datos del Ministerio de Salud. En ese contexto, que miles de frascos comprados con dinero público terminen en la basura agrava la escasez que ya enfrentan los pacientes.
Indyra Oropeza, vocera del colectivo Semáforo Oncológico, lo vivió en carne propia. Cuando le diagnosticaron leucemia, su tratamiento fue interrumpido durante la pandemia en el INEN. Contó su experiencia en un blog y luego fundó la ONG Con L de Leucemia. Desde entonces acompaña a pacientes que intentan conseguir por su cuenta lo que el hospital no puede ofrecer.
—Algunos pacientes se endeudan para comprar los medicamentos en farmacias privadas. Pero incluso con dinero, el acceso no está garantizado. No todos se encuentran fácilmente. Cuando el sistema público no los tiene, muchas veces solo queda esperar.
En gran medida, el Perú depende de medicamentos oncológicos genéricos que provienen de la India. En 2024 importó desde ese país productos farmacéuticos por aproximadamente US$ 120,7 millones, según la base oficial de comercio internacional de Naciones Unidas.
La India concentra cerca del 20 % de la producción mundial de medicamentos genéricos por volumen y abastece a más de 200 países, según la India Brand Equity Foundation (IBEF), una entidad vinculada al Ministerio de Comercio e Industria encargada de promover la imagen económica del país en el exterior. Esa magnitud convierte en decisivos los controles sanitarios en los países importadores.
En el papel, el Estado peruano cuenta con un sistema para proteger a la población de medicamentos inseguros. La Organización Panamericana de la Salud ha señalado que trabajó con las autoridades para fortalecer la regulación. Sin embargo, los episodios recientes plantean una pregunta inevitable: ¿cómo ha terminado el país importando tantos medicamentos que luego deben retirarse o destruirse?
Para José Gonzales, quien dirigió el Cenares en tres periodos entre 2016 y 2022, existe una falla en el engranaje regulatorio.
—Cuando tienes que devolver medicamentos o dejar de usarlos, el país queda en una situación crítica, porque no hay muchos productores o comercializadores de oncológicos —afirma.
El impacto no termina con la devolución. Las reposiciones pueden fallar y las nuevas compras tardan meses, un plazo que los pacientes no tienen.
Gonzales propone modificar el esquema de adquisición. Una alternativa es la precalificación: contar previamente con dos o tres laboratorios evaluados y habilitados. Si uno incumple, el Estado podría activar de inmediato al siguiente sin iniciar un nuevo proceso de compra. Eso reduciría semanas —o incluso meses— de espera y evitaría interrupciones en los tratamientos.
Catorce lotes defectuosos sin alerta pública
De los 19 lotes de medicamentos contra el cáncer rechazados por problemas de calidad entre 2019 y 2025, solo cinco fueron comunicados públicamente por la Digemid mediante alertas sanitarias: el cisplatino de Beta Drugs, la ifosfamida de United Biotech y tres de la ciclofosfamida de Kwality Pharmaceuticals.
Los otros catorce no generaron ninguna alerta.
Consultada para esta investigación, la Digemid no concedió entrevistas. Respondió por escrito a los pedidos presentados bajo la Ley de Transparencia y Acceso a la Información Pública. Señaló que no consideró necesario emitir alertas porque, cuando recibió los resultados de laboratorio, los productos ya habían sido destruidos y no estaban en circulación.
Pero una alerta sanitaria no solo sirve para retirar un lote del mercado. También deja constancia pública de que un producto o un fabricante presentó fallas. Ese registro debe orientar futuras compras del Estado, alertar a otros hospitales y alimentar los sistemas regulatorios de otros países que vigilan la seguridad de los medicamentos que circulan internacionalmente.
Sin ese aviso, el antecedente se diluye. El riesgo no queda formalizado y se pierde la oportunidad de prevenir que el problema se repita.
El contexto internacional ayuda a dimensionar lo que está en juego. En 2017, la Organización Mundial de la Salud estimó que más del 10 % de los medicamentos en el mundo presentan defectos de calidad.
—En el mundo se consumen miles de millones de dosis. Incluso si solo el 10 % es de mala calidad, las implicancias para la salud pública son enormes —advierte Paul Newton, director del Medicine Quality Research Group de la Universidad de Oxford.
Newton, quien investiga medicamentos de mala calidad desde hace casi 30 años, señala que la mayoría de países enfrenta desafíos severos en la regulación sanitaria.
—Existe un problema importante con autoridades regulatorias que no cuentan con suficiente capacidad humana ni financiera para cumplir con el mandato que tienen —añade.
Aunque el problema es más agudo en países de menores ingresos, las naciones ricas pueden enfrentar dificultades similares. Estados Unidos ha experimentado graves episodios de desabastecimiento de medicamentos oncológicos en los últimos años, y el año pasado se informó que su regulador estaba permitiendo importaciones desde cientos de fabricantes previamente vetados para mantener el suministro. Mientras tanto, el regulador del Reino Unido, considerado uno de los más estrictos del mundo, investiga actualmente la llegada de medicamentos de quimioterapia que no superaron pruebas de calidad.
—Sería muy ingenuo que cualquier país del mundo diga que no está en riesgo de medicamentos de mala calidad —dijo Newton.
La OMS calcula que los países pierden alrededor de 30.000 millones de dólares al año en productos médicos de calidad inferior o falsificados. Son recursos que podrían destinarse a tratamientos eficaces.
En el caso peruano, encontramos, además, un segundo vacío. Hasta hace poco, en el país no existía una norma que obligara a retirar del mercado todos los medicamentos de un laboratorio que no aprobaba la certificación de Buenas Prácticas de Manufactura.
Durante años, cuando una planta extranjera no superaba la inspección de la Digemid, sus nuevos lotes quedaban bloqueados. Pero los productos que ya habían ingresado al país podían seguir utilizándose en hospitales.
Ese criterio empezó a cambiar recién en 2025, tras el caso del sedante Edetoxin contaminado que fue administrado a 28 pacientes, incluidos niños y bebés en unidades de cuidados intensivos.
Desde octubre, la Digemid comenzó a suspender los registros sanitarios de medicamentos fabricados por laboratorios que no aprobaron la certificación de BPM. Hasta el 22 de enero de 2026, 297 productos —principalmente de India y China— ya no podían comercializarse en el país.
Las fallas que nadie rastrea
Cuando un medicamento no hace efecto o, peor aún, provoca un daño, alguien debería encender una alerta. Para eso existe el sistema de farmacovigilancia a cargo de la Digemid: médicos, farmacéuticos y laboratorios están obligados a reportar sospechas de reacciones adversas y también los casos en que un tratamiento no funciona como debería. En teoría, cada señal —un paciente que no mejora, un efecto inesperado— tendría que quedar registrada.
Pero el sistema depende de que alguien dé el paso. Si no lo hace, el caso no ingresa a ningún registro y, para la autoridad sanitaria, simplemente queda fuera del radar. Tampoco hay un monitoreo sistemático que permita saber cuántos pacientes responden a un esquema de tratamiento y cuántos no, ni un cruce automatizado entre la evolución clínica y el lote específico administrado. La información permanece dispersa en cada hospital.
Médicos de hospitales públicos y del seguro social consultados para esta investigación coinciden en que el subregistro es frecuente. Con jornadas que superan los 30 o 40 pacientes al día, completar reportes adicionales no siempre es viable.
Una doctora de EsSalud, que pidió mantener su nombre en reserva, explica cómo esa dinámica opera en la práctica:
—Es más fácil consignar que el paciente falleció por el avance del cáncer que abrir un reporte de posible toxicidad o falla del medicamento. Eso implica más tiempo, más papeleo. Y el tiempo no alcanza.
A esto se suma una debilidad estructural. La Digemid cuenta con recursos y trabajadores limitados para analizar y dar seguimiento a las notificaciones que recibe. Así, los reguladores terminan reaccionando a los casos más graves, pero no necesariamente detectan problemas menos visibles.
En ese contexto, cuando una quimioterapia no produce la respuesta esperada, lo habitual es atribuirlo a la evolución del cáncer o a las condiciones del paciente. Rara vez se examina si pudo influir la calidad del medicamento, una concentración inferior a la declarada o fallas en su producción.
—Si aplicas un tratamiento y solo tres de cada diez pacientes responden, hay que preguntarse por qué. Eso no se está evaluando— advierte el oncólogo Víctor Palacios.
Las compras públicas muestran que ese riesgo no es hipotético.

En 2019, el Cenares hizo una compra internacional de 50.000 unidades de ciclofosfamida —un medicamento esencial para tratar cáncer de mama, leucemias y sarcomas— al fabricante indio Vee Excel Drugs & Pharmaceuticals. En una primera entrega ingresaron al país 15.000 unidades correspondientes a un lote.
Los análisis realizados en el Perú detectaron algo grave: el fármaco tenía solo el 37,2 % de la concentración declarada, presentaba residuos sólidos sin disolver y no era estéril, pues se detectó crecimiento bacteriano.
La falta de esterilidad en un medicamento inyectable es especialmente peligrosa. El doctor Paul Newton advierte que cuando un fármaco se inyecta va directo al organismo, sin las barreras naturales que sí existen, por ejemplo, en el sistema digestivo:
—En el estómago tenemos ácidos que eliminan muchos microorganismos. Pero cuando algo se inyecta, se saltan esos mecanismos de defensa. Si el medicamento está contaminado, puede causar una infección grave e incluso la muerte, dependiendo del microorganismo.
En una entrevista para esta investigación, el CEO de Vee Excel Pharmaceuticals, Vipin Bansal, reconoció que hubo un problema con la ciclofosfamida enviada al Perú, aunque dijo no recordar la causa exacta:
—Probablemente no hubo un control adecuado de temperatura durante el tránsito y por eso se produjo cierto deterioro del fármaco. No lo recuerdo con precisión, pero las muestras que teníamos bajo nuestras condiciones de control estaban bien.
El laboratorio envió cinco lotes de reemplazo. Solo uno cumplió con los estándares exigidos. Los otros presentaban concentraciones por debajo del mínimo permitido o un nivel de pH fuera de los parámetros aprobados en el registro sanitario. Tras ello, el Cenares solo aceptó el único lote conforme, compuesto por 3.550 unidades, y resolvió parcialmente el contrato.
Según la entidad, no fue necesario realizar una nueva compra porque, en agosto de 2020, el consumo del medicamento había disminuido debido a la pandemia y existía stock suficiente para cubrir la demanda durante aproximadamente un año.
Pero la historia no terminó ahí. La Digemid multó al Cenares con S/ 138.000 porque, al tratarse de una compra internacional, la propia entidad figuraba como titular del registro sanitario. Eso implicaba que era legalmente responsable de garantizar que el medicamento cumpliera los estándares de calidad antes de ingresar al país.
En la práctica, el Estado terminó sancionándose a sí mismo: la autoridad encargada de vigilar la calidad multó a la entidad responsable de la compra. Pero esto no corrigió el problema ni devolvió el tiempo perdido. El circuito de compra y control no cambió.
Un caso similar ocurrió en 2024 con otro proveedor de ciclofosfamida. El laboratorio indio Kwality Pharmaceuticals debía suministrar 10.000 viales al Cenares, como parte de un contrato firmado con la empresa importadora DS Pharma.
Sin embargo, los dos lotes asignados presentaban partículas visibles y fueron declarados no conformes antes de su entrega. Según informó DS Pharma en un comunicado remitido para esta investigación, el producto fue incinerado tras detectarse la irregularidad y nunca ingresó los almacenes de los hospitales. El contrato fue resuelto.
También hay casos en los que el Estado, pese a detectar fallas en un proveedor, reduce la sanción y continúa contratándolo.
En febrero de 2023, el Cenares contrató a la empresa Seven Pharma para proveer 30.000 unidades de doxorubicina fabricadas por el laboratorio indio Naprod Life Sciences. En la primera entrega de un lote de 10.000 unidades, el análisis de control de calidad detectó partículas extrañas y el producto fue declarado no conforme.
La Digemid multó con 24.750 soles al laboratorio importador, que aceptó los cargos y obtuvo una reducción del 50% de su sanción. El contrato con el Cenares no solo continuó, sino que se amplió para adquirir otras 7.500 unidades del mismo medicamento.
Préstamos de emergencia
Los medicamentos oncológicos que fueron declarados defectuosos y terminaron destruidos no solo dejaron un vacío en los almacenes. En varias ocasiones obligaron a los hospitales a prestarse entre sí sus reservas para no suspender quimioterapias.
En 2022 ocurrió con una compra de ifosfamida que no cumplía los estándares de calidad. Para evitar que los tratamientos se detuvieran, los hospitales Goyeneche de Arequipa y el Regional de Cajamarca enviaron parte de sus propios lotes a Lima.
El Cenares había adquirido 24.000 viales a North Life Pharma. La primera entrega —12.000 frascos— no presentó observaciones. La segunda fue rechazada: el medicamento tenía un color inusual y contenía materia extraña. Había sido fabricado por United Biotech, en la India.

La reposición no resolvió el problema. En enero de 2023, el nuevo envío volvió a presentar fallas: las muestras mostraban puntos negros e incluso fragmentos de vidrio. Los análisis realizados en el Perú confirmaron que no podía usarse.
North Life Pharma sostuvo que ambos envíos habían sido evaluados por tres laboratorios independientes —uno de ellos europeo, en un país con alta vigilancia sanitaria— antes de su exportación, sin que se detectaran irregularidades. Pero en el Perú los resultados fueron distintos y los productos no pudieron ingresar, para evitar cualquier riesgo para la salud pública.
El envío desde Arequipa y Cajamarca sostuvo temporalmente las quimioterapias en Lima mientras el Cenares iniciaba una nueva compra. Pero redujo las reservas en esas regiones y dejó a sus pacientes en riesgo de suspender o no recibir a tiempo sus propias sesiones.
Hugo conoce la angustia de esa espera.
—Lo bueno es que mi tratamiento va por buen camino. Los valores tumorales han bajado y el tumor se sigue reduciendo.
Durante semanas no supo si habría medicamento para continuar.
En ese intervalo —entre la compra fallida y la reposición— transcurre un tiempo que el cáncer no concede.
*Usamos un seudónimo para proteger la identidad del paciente.
Respuestas y silencios tras los lotes defectuosos
Desde octubre de 2025, Salud con lupa y The Bureau of Investigative Journalism solicitaron entrevistas a los directores del Cenares, la Digemid, la Dirección de Prevención y Control del Cáncer y hospitales públicos, todos bajo el ámbito del Ministerio de Salud. La Dirección de Comunicaciones del Minsa respondió que no había voceros disponibles y que solo atenderían por escrito mediante solicitudes de acceso a la información pública. A través de ese mecanismo se obtuvieron parte de sus respuestas.
Entre noviembre y enero de este año, pedimos descargos a los laboratorios indios vinculados a los lotes observados. Beta Drugs, United Biotech y Kwality Pharmaceuticals no respondieron. Naprod Life Sciences afirmó que cumple estándares internacionales de calidad y que el lote cuestionado siguió los procedimientos regulatorios.
Por su parte, Vee Excel Drugs & Pharmaceuticals, a través de su director ejecutivo Vipin Bansal, sostuvo que solo uno de cinco lotes presentó fallas, que fue reemplazado, y atribuyó el problema a condiciones de transporte. También indicó que la venta respondió a una compra de emergencia y que su certificación de Buenas Prácticas de Manufactura estaba en trámite cuando la pandemia interrumpió el proceso.